

- Typ-2-Diabetes ist eine der häufigsten und zugleich folgenreichsten Erkrankungen des 21. Jahrhunderts. Oft bleibt die Krankheit über viele Jahre unentdeckt.
- Typ-2-Diabetes ist mit zahlreichen Folgeschäden assoziiert, darunter Herz-Kreislauf-Erkrankungen, Organschäden und Adipositas.
- Behandelt werden nicht nur der erhöhte Blutzucker, sondern alle Komorbiditäten.
- Sofern keine Kontraindikationen bestehen, ist Metformin das Antidiabetikum der ersten Wahl. SGLT-2-Hemmer und GLP-1-Agonisten stehen an zweiter Stelle.
- PTA können Betroffene beraten und ihnen Ratschläge zum Management ihrer Erkrankung geben.
Jeder elfte Erwachsene ist Diabetiker – das sind 425 Millionen Menschen weltweit. Mindestens acht Millionen davon leben in Deutschland. Die verbreitetste Form von Diabetes ist der Typ-2-Diabetes (T2D), der etwa 90 Prozent aller Fälle ausmacht. Da immer öfter auch jüngere Menschen an T2D erkranken, ist die frühere Bezeichnung „Altersdiabetes“ mittlerweile nicht mehr üblich.
Lernziele
Nach Lektüre dieser Lerneinheit wissen Sie, ...
- wie Typ-2-Diabetes entsteht.
- warum es nötig ist, Typ-2-Diabetes rechtzeitig zu erkennen und zu behandeln.
- welche Probleme Typ-2-Diabetes verursacht.
- welche Ziele die Behandlung verfolgt.
- welche Medikamente zur Verfügung stehen.
- was bei der Blutzuckermessung und Unter- zuckerungen zu beachten ist.
Grundlagen
T2D ist eine chronisch-fortschreitende, multifaktorielle Erkrankung des Glukosestoffwechsels und durch eine unzureichende Wirksamkeit des köpereigenen Hormons Insulin gekennzeichnet (Insulinresistenz), dem die Bauchspeicheldrüse mit vermehrter Eigenproduktion begegnet (Hyperinsulinismus). Irgendwann ist sie jedoch erschöpft und der Insulinüberschuss schlägt in einen Insulinmangel um (Insulinsekretionsstörung).
Ursachen
Die initiale Insulinresistenz bei T2D ist fast immer Folge von energiereicher, ballaststoffarmer Ernährung und körperlicher Inaktivität. Selbst Menschen mit genetischem Hintergrund können den Ausbruch der Erkrankung durch eine bewusste Nahrungsmittelwahl und regelmäßigen Sport nachweislich verhindern. Bleibt man hingegen untätig, sind aufgrund des Insulinüberschusses mit der Zeit immer weniger Insulinrezeptoren auf der Zelloberfläche verfügbar. Dies liegt daran, dass die Zellen bei ständigem Kontakt mit zu viel Insulin weniger empfindlich dafür werden – der Blutzuckerwert steigt. Das Überangebot an Insulin fördert parallel eine Gewichtszunahme. Auch Blutdruck und Fettstoffwechsel geraten aus dem Gleichgewicht.
Symptome und Diagnose
T2D entwickelt sich schleichend (leiser Killer). Oft bleibt die Erkrankung über Jahre unentdeckt. Für gewöhnlich ist der krankhaft erhöhte Blutzuckerspiegel ein Zufallsbefund, wenn sich betroffene Personen aufgrund einer anderen Erkrankung untersuchen lassen oder ein schweres kardiovaskuläres Ereignis erleiden (z. B. Herzinfarkt). Typische, aber unspezifische Beschwerden sind Durst, Heißhunger, vermehrtes Wasserlassen und Müdigkeit. Endgültig diagnostizieren können Ärzte einen T2D erst dann, wenn sie eine Blutabnahme machen.
Sowohl die Deutsche als auch die Amerikanische Diabetes Gesellschaft fordern dafür standardisierte Laborwerte für Plasmaglukose (Grenzwert: 125 mg/dl nüchtern, normal: unter 100 mg/dl) und Hämoglobin A1c (HbA1c; Grenzwert: 6,5 %, normal: unter 5,7 %). Berücksichtigung finden außerdem die Familienanamnese, eine körperliche Untersuchung (z. B. Body-Mass-Index, Taille-Hüft-Verhältnis, Blutdruck) sowie Blutwerte (u. a. C-Peptid als Maß für die körpereigene Insulinsekretion, Lipidprofil). Bei jüngeren Menschen erfolgt gegebenenfalls eine Abklärung hinsichtlich vorhandener Autoantikörper (Differenzialdiagnose für Typ-1-Diabetes).
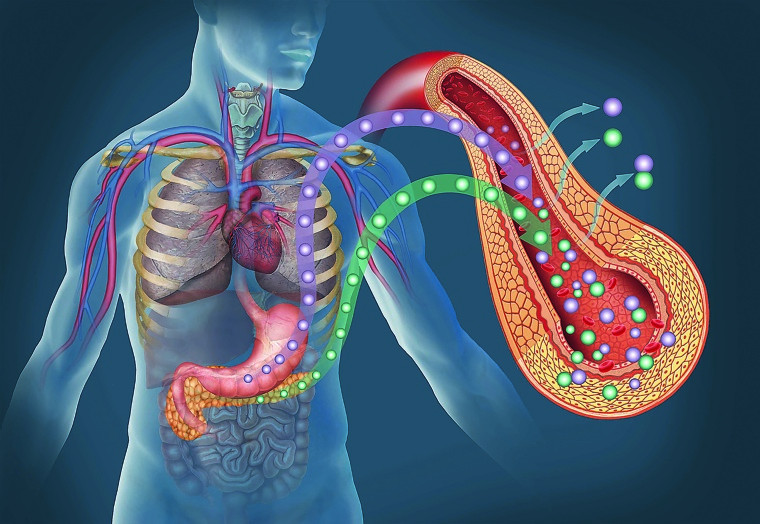
© Foto: ilusmedical / Stock.adobe.com
Bei Typ-2-Diabetes reagiert die Bauchspeicheldrüse zunächst mit Hyperinsulinismus auf die unzureichende Wirksamkeit des körpereigenen Hormons Insulin (Insulinresistenz). Später schlägt der Insulinüberschuss in einen Insulinmangel um (Insulinsekretionsstörung).
Behandlungsziele
Übergeordnetes Ziel der Therapie ist es, die kardiovaskuläre Erkrankungs- (Morbidität) und Sterberate (Mortalität) zu verringern und Folgeerkrankungen zu vermeiden. Als Basis fungiert eine nachhaltige Änderung des Lebensstils, die, sofern sie beibehalten wird, die Risiken erheblich verringert. Medikamentöse Interventionen orientieren sich an festgelegten Zielwerten und berücksichtigen:
- Langzeitblutzucker (in der Regel HbA1c-Wert von 6,5– 7,5 %, keine Unterzuckerungen),
- Nüchternblutzucker (vor dem Essen 90 – 120 mg/dl),
- Blutdruck (generell < 140/80 mmHg),
- Low-Density-Lipoprotein-Cholesterin (LDL-C; meist < 70 mg/dl) und
- Gewicht (normalgewichtig mit BMI 20 – 25 kg/m2).
HbA1c-- Der rote Blutfarbstoff Hämoglobin (Hb) ist für den Transport von Sauerstoff und Kohlendioxid im Blut verantwortlich. Die bei Diabetes erhöhten Blutzuckerwerte sorgen dafür, dass Glukosemoleküle häufiger an Hämoglobin und andere Proteine binden. Je höher der HbA1c-Wert, desto höher der Anteil glykosylierter („verzuckerter“) Hämoglobinmoleküle und desto höher der durchschnittliche Blutzucker. Aufgrund der mittleren Lebensdauer der Erythrozyten von acht bis zwölf Wochen kann man auf diese Weise den Langzeitblutzucker ermitteln. Niedrige HbA1c-Werte ohne Unterzuckerungen korrelieren mit einem verlängerten Überleben und einer besseren Lebensqualität.
Viele Probleme
T2D ist mit Herz-Kreislauf-Problemen, Fettstoffwechselstörungen und Adipositas assoziiert. Schlecht eingestellte Patienten haben ein erhöhtes Risiko für kardiovaskuläre Folgeerkrankungen und diverse Organschäden.
Blutdruckprobleme
T2D und Bluthochdruck sind anerkannte kardiovaskuläre Risikofaktoren. Menschen mit T2D profitieren von einem normalen Blutdruck, weshalb dieser regelmäßig kontrolliert und gegebenenfalls medikamentös gesenkt werden sollte. Ein gut eingestellter Blutdruck reduziert Schäden an den großen und kleinen Gefäßen. Mittel der Wahl sind ACE-Hemmer oder Sartane, da sie stoffwechselneutral sind, also keinen Einfluss auf den Blutzucker- und Fettstoffwechsel haben, und nierenschützend (nephroprotektiv) wirken. Calciumkanalblocker und Thiaziddiuretika eignen sich als Kombinationspartner. Unabhängig von ihren blutzuckersenkenden Eigenschaften haben SGLT-2-Hemmer (Sodium-Glucose-Linked-Transporter-2-Hemmer) und GLP-1-Agonisten (Glukagon-Like-Peptid-1-Agonisten) einen blutdrucksenkenden Effekt, den man sich in der Behandlung zunutze macht.
Fettstoffwechselprobleme
Störungen im Fettstoffwechsel verursachen Ablagerungen an der Innenwand von Gefäßen (= Arteriosklerose) und erhöhen das kardiovaskuläre Risiko. Ursächlich ist die Insulinresistenz, die mit einem Anstieg freier Fettsäuren und Triglyzeriden einhergeht. Charakteristisch für T2D sind also hohe Triglyzerid-, hohe LDL-Cholesterin- und niedrige HDL-Cholesterin-Werte. Für die Behandlung derartiger Fettstoffwechselprobleme sind Hochdosis-Statine (Atorvastatin, Rosuvastatin) die Lipidsenker der Wahl. Fibrate und Eicosapentaensäure sind Optionen bei dauerhaft stark erhöhten Triglyzeridwerten.
Augenprobleme
Diabetische Retinopathien gehören zu den weltweit häufigsten Ursachen vermeidbarer Blindheit im Erwachsenenalter. Der geringe Durchmesser der Gefäße im Auge prädestiniert sie für diabetesbedingte Langzeitschäden. Augenärzte können das Ausmaß der Gefäßschäden mithilfe optischer Hilfsmittel bestimmen und eine Retinopathie anhand etwaiger Mikroaneurysmen (sackartige Ausbuchtungen von Blutgefäßen als Zeichen einer geschwächten Gefäßwand), retinaler Blutungen oder anderer Abnormitäten feststellen. Der jährliche Augenarzttermin sollte für alle Diabetiker einen festen Platz im Kalender einnehmen.
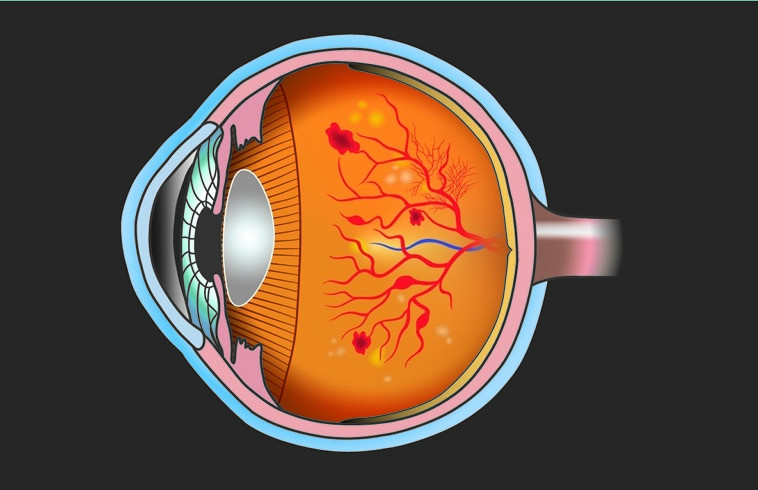
© Foto: PATTARAWIT / Stock.adobe.com
Bei der diabetischen Retinopathie sind Blutgefäße im Auge beschädigt, was Blutungen, Ödeme und weitere Schäden nach sich führt. Im schlimmsten Fall erblindet der Betroffene.
Nervenprobleme
Schätzungen gehen davon aus, dass rund 60 bis 90 Prozent aller Menschen mit T2D an einer Neuropathie leiden. Insbesondere symmetrische Nervendefekte der Hände und Füße sind weit verbreitet. Symptome umfassen mitunter Taubheitsgefühl, Missempfindungen sowie nächtliche Wadenkrämpfe. Bei zehn bis 20 Prozent der Patienten bedingen die strukturellen Veränderungen an den Nerven behandlungsbedürftige, schmerzhafte Beschwerden wie Kribbeln, Brennen, Ameisenlaufen oder Berührungsempfindlichkeit.
Nierenprobleme
Die diabetische Nierenerkrankung betrifft bis zu 40 Prozent aller Menschen mit T2D. Rund die Hälfte entwickelt nach zehn Jahren ein terminales (fortgeschrittenes) Nierenversagen. Dieser Anteil steigt nach 20 Jahren sogar auf bis zu 75 Prozent, sofern der Diabetes nicht medikamentös behandelt wird. Wie der T2D verläuft auch die diabetische Nierenerkrankung oftmals unbemerkt, bis ein bereits eingetretener Nierenschaden nicht mehr umkehrbar ist. Sie ist nach wie vor eine der wichtigsten Ursachen für chronisches Nierenversagen und Dialysebehandlung.
Gewichtsprobleme
Mehr als 90 Prozent der Menschen mit T2D sind übergewichtig oder adipös. Ein hoher Insulinspiegel fördert die Einlagerung von Kohlenhydraten als Fett. Umgekehrt ist Adipositas aber auch eng mit dem Auftreten von T2D verknüpft. Forscher gehen davon aus, dass die zunehmende Fettmasse vermehrt Entzündungsbotenstoffe freisetzt, die unter anderem kardiovaskuläre oder metabolische Folgeerkrankungen verursachen. Die sich in den Muskelzellen ablagernden Fette stören zudem die Wirkung von Insulin, indem sie die Verschiebung von Glukosetransportern auf die Zelloberfläche verhindern und eine Insulinresistenz begünstigen.
Hautprobleme
Jeder zweite Mensch mit T2D leidet unter Hautsymptomen wie Juckreiz, trockener Haut oder Pilzinfektionen, die entweder im Verlauf der Erkrankung auftreten oder sogar schon Jahre vorher einen Diabetes ankündigen können. Warum das so ist, konnten Wissenschaftler bisher nicht restlos erklären. Vermutet wird, dass der erhöhte Blutzuckerspiegel eine wichtige Rolle spielt. Er führt zu Störungen in den Haut-, Bindegewebs- und Fettzellen, löst Prozesse aus, die Auswirkungen auf die körpereigene Immunabwehr haben, und beeinflusst Gefäße und Nerven.

© Foto: Grafik: DAS PTA MAGAZIN / Illustration: [M] elenabs/ Getty Images / iStock
Diese Grafik veranschaulicht die potenziellen Komplikationen, die im Verlauf der Erkrankung auftreten können, darunter Herzerkrankungen, Nierenprobleme, Neuropathie und Sehverlust. Die sorgfältige Kontrolle des Blutzuckers ist oberstes Gebot.
Medikamente
Um den erhöhten Blutzucker und damit verbundene Folgeschäden zu reduzieren, werden Antidiabetika eingesetzt. Darunter fallen Insuline, insulinfreisetzende und nicht insulinfreisetzende Wirkstoffe. Insulinfreisetzende Antidiabetika stimulieren auf unterschiedliche Weise die Insulinsekretion. Dazu gehören Sulfonylharnstoffe, Glinide, Gliptine und GLP-1-Agonisten. Nicht insulinfreisetzende Antidiabetika wirken durch vermehrte Glukoseausscheidung, verminderte Glukoseresorption oder verbesserte Insulinwirkung in den Zielgeweben. Hierzu zählen Metformin, SGLT-2-Hemmer, Glitazone und α-Glukosidase-Hemmer. Eine Übersicht bietet die Tabelle weiter unten.
- Moderne Antidiabetika müssen aber noch mehr können. Sie sollen:
- sicher in der Anwendung sein (geringes Risiko für Unterzuckerungen),
- einfach in der Anwendung sein,
- gewichtsreduzierend oder zumindest gewichtsneutral wirken,
- das stark erhöhte kardiovaskuläre Risiko reduzieren und
- Organe vor blutzuckerbedingten Langzeitschäden schützen.
Stufenkonzept
Das Stufenkonzept der Deutschen Diabetesgesellschaft empfiehlt, im ersten Schritt die Ernährungsgewohnheiten zu ändern, die körperliche Aktivität zu steigern sowie den Tabak- und Alkoholkonsum zu limitieren. Medikamentös ist und bleibt bei T2D Metformin das Antidiabetikum der Wahl. Bei bekanntem kardiovaskulären und/oder renalen Risiko beziehungsweise Übergewicht sollte Metformin jedoch alsbald mit einem SGLT-2-Hemmer oder einem GLP-1-Agonisten kombiniert werden. Gegebenenfalls folgen eine Drei- oder Vierfachtherapie (z. B. Metformin, SGLT-2-Hemmer, GLP-1-Agonist) beziehungsweise die Einleitung einer Basalinsulin-unterstützten Therapie. Reicht auch das nicht mehr aus, werden Patienten mit T2D genauso wie Patienten mit Typ-1-Diabetes auf eine funktionelle Insulintherapie mit kurz- und langwirksamen Insulinen eingestellt.
Metformin
Metformin ist der letzte verbliebene Vertreter der Biguanide und hat angesichts überzeugender Langzeitstudien stark an Bedeutung gewonnen. Es blockiert die Atmungskette in den Hepatozyten und somit die Glukoseproduktion in der Leber. Zudem verbessert Metformin die Insulinwirkung und Glukoseaufnahme in die Zielzellen. Gastrointestinale Nebenwirkungen lassen sich durch langsames Aufdosieren deutlich vermindern. Die potenziell lebensbedrohliche Laktatazidose ist sehr selten und tritt vor allem bei Nichtbeachtung der Kontraindikationen auf. Betroffen sind meist ältere, niereninsuffiziente oder herzinsuffiziente Menschen.
Einteilung oraler Antidiabetika |
||
|
Arzneistoffgruppe |
Wirkstoff(e) * |
Hauptwirkung |
|
Insulinfreisetzende Antidiabetika |
||
|
GLP-1-Agonisten |
Dulaglutid, Exenatid, Semaglutid, Liraglutid |
verstärken Insulinsekretion |
|
Glinide |
Repaglinid |
verstärken Insulinsekretion |
|
Sulfonylharnstoffe |
Glibenclamid, Glimepirid |
verstärken Insulinsekretion |
|
DPP4-Hemmer/Gliptine |
Linagliptin, Sitagliptin, Saxagliptin, Vildagliptin |
verstärken Insulinsekretion |
|
Nicht insulinfreisetzende Antidiabetika |
||
|
Biguanide |
Metformin |
blockieren Glukoseproduktion in der Leber, verbessern Insulinwirkung und Glukoseaufnahme in Zielzellen |
|
SGLT-2-Hemmer/Gliflozine |
Empagliflozin, Dapagliflozin |
steigern Glukoseausscheidung mit dem Urin |
|
Glitazone/Insulinsensitizer |
Pioglitazon |
verbessern Insulinwirkung |
|
α-Glukosidase-Hemmer |
Acarbose |
blockieren Glukoseresorption |
*beispielhafte Nennungen ohne Anspruch auf Vollständigkeit (Stand der Informationen: 12.10.2023)
SGLT-2-Hemmer/Gliflozine
Unter physiologischen Bedingungen werden 90 Prozent der glomerulär-filtrierten Glukose über ein Transportprotein im proximalen Tubulus der Niere (Sodium dependent glucose transporter-2; SGLT-2) rückresorbiert. SGLT-2-Hemmer blockieren diesen Transporter, was zu einer gesteigerten Glukoseausscheidung über die Nieren führt. Da die Wirkstoffnamen auf -gliflozin enden, werden SGLT-2-Hemmer auch Gliflozine genannt. Wirkstoffbeispiele sind Empagliflozin und Dapagliflozin. Sie reduzieren das kardiovaskuläre Risiko, wirken nierenschützend, senken den Blutdruck, verursachen keinen Unterzucker und fördern eine Gewichtsabnahme. Infolgedessen stehen SGLT-2-Hemmer bei Ärzten hoch im Kurs. Zu beachten sind vermehrte Pilzinfektionen im Intimbereich und Harnwegsinfekte.
GLP-1-Agonisten/Inkretinmimetika
GLP-1-Agonisten wie Liraglutid oder Semaglutid sind Abkömmlinge des natürlichen Polypeptids GLP-1 mit verlängerter Wirkdauer. Als GLP-1-Analoga aktivieren sie den GLP-1-Rezeptor (Glukagon-Like-Peptid-1-Rezeptor) und verstärken die Insulinsekretion, lösen sie jedoch nicht aus (glukoseabhängige Wirkung). GLP-1 gehört zu den Inkretinen und spielt eine wichtige Rolle im Glukosestoffwechsel. Daher tragen GLP-1-Agonisten auch die Bezeichnung Inkretinmimetika. Endpunktstudien bestätigen eine Reduktion des kardiovaskulären Risikos. Unterzuckerungen sind sehr selten und treten meist in Kombination mit Insulin oder Sulfonylharnstoffen auf.
Im Gegensatz zu anderen Antidiabetika müssen GLP-1-Agonisten subkutan (unter die Haut) injiziert werden – je nach Präparat ein- bis zweimal pro Tag oder einmal in der Woche. Eine Ausnahme bildet Semaglutid, das auch als orales Antidiabetikum vorliegt und einmal täglich eingenommen wird. Nebenwirkungen wie Völlegefühl und Übelkeit sind vor allem zu Therapiebeginn präsent, verschwinden aber normalerweise nach ein bis zwei Wochen. In höherer Dosierung sind zwei Vertreter explizit zur Gewichtsreduktion bei krankhaftem Übergewicht zugelassen (Liraglutid, Semaglutid).
DPP4-Hemmer/Gliptine
Gliptine blockieren das Enzym Dipeptidylpeptidase-4 (DDP-4) und hemmen dadurch den physiologischen Abbau von GLP-1. Im Gegensatz zu GLP-1-Analoga sind Gliptine zwar kardiovaskulär neutral, bis jetzt konnte allerdings keine kardioprotektive Wirkung festgestellt werden. Aufgrund ihrer guten Verträglichkeit werden sie gern bei geriatrischen Patienten verordnet, da diese anfälliger für Unterzuckerungen und zentralnervöse Nebenwirkungen sind. Gliptine sind zudem gewichtsneutral. Bei vielen geriatrischen Patienten ist, im Gegensatz zu jüngeren Patienten, eine Gewichtsabnahme unerwünscht. Wie bei den GLP-1-Agonisten sind die gastrointestinalen Nebenwirkungen zu Behandlungsbeginn in der Regel selbstlimitierend. Wirkstoffbeispiele sind Sitagliptin und Saxagliptin.
Wussten Sie, dass ...
- Gestationsdiabetes eine Glukosetoleranzstörung ist, die erstmals während der Schwangerschaft auftritt?
- ein vorbekannter Diabetes kein Gestationsdiabetes ist?
- das Risiko im zweiten Schwangerschaftsdrittel am größten ist?
- die Vorsorgeuntersuchung deshalb zwischen der 24. und 28. Schwangerschaftswoche stattfindet?
- ein Alter über 45 Jahren, hohes Körpergewicht und Bluthochdruck einen Gestationsdiabetes wahrscheinlicher machen?
- Insulin das einzige Antidiabetikum ist, das in der Schwangerschaft nicht kontraindiziert ist?
Sulfonylharnstoffe
Sulfonylharnstoffe wie Glibenclamid oder Glimepirid leiten sich strukturell von den antibakteriell wirksamen Sulfonamiden ab. Sie binden in den Betazellen der Bauchspeicheldrüse an die SUR1-Untereinheit ATP-gesteuerter Kaliumkanäle. Die Schließung dieser Kaliumkanäle bewirkt eine reflektorische Öffnung von Calciumkanälen mit der Folge einer gesteigerten Insulinfreisetzung. Sulfonylharnstoffe werden seltener als früher verschrieben, da es Hinweise auf ungünstige kardiovaskuläre Effekte gibt. Unterzuckerungen und Gewichtszunahme sind angesichts der insulinfreisetzenden Wirkung ebenfalls zu berücksichtigen.
Glinide
Glinide wie Repaglinid sind Benzoesäurederivate mit einer den Sulfonylharnstoffen sehr ähnlichen Wirkung. Sie stimulieren die Insulinfreisetzung, indem sie die ATP-abhängigen Kaliumkanäle der Betazelle schließen, allerdings an einer anderen Bindungsstelle als Sulfonylharnstoffe. Ihre rasche Bioverfügbarkeit und kurze Halbwertszeit ermöglichen eine bedarfsorientierte Einnahme. Seitdem Glinide zulasten der gesetzlichen Krankenkassen wegen fehlender Nutzenbelege nur mehr in medizinisch begründeten Einzelfällen verordnet werden dürfen, sieht man sie kaum noch.
Glitazone
Auch der letzte Vertreter der Insulinsensitizer, Pioglitazon, spielt keine wesentliche Rolle mehr in der Therapie des T2D. Glitazone verbessern die Insulinwirkung im Leber-, Muskel- und Fettgewebe. Dies hat günstige metabolische Effekte (u.a. Lipidsenkung und verminderte viszerale Lipidakkumulation). Weil Glitazone mit Herzinsuffizienz und Knochenbrüchen in Verbindung stehen, hat der gemeinsame Bundesausschuss entschieden, dass die Nachteile den möglichen Nutzen überwiegen (= weitgehender Verordnungsausschluss).
α-Glukosidase-Hemmer
α-Glukosidase-Hemmer blockieren die Glukoseresorption an der Bürstensaummukosa des Dünndarms, indem sie die Spaltung von Oligo- und Disacchariden durch das Enzym Glukosidase verhindern. Sie selbst werden kaum resorbiert. Acarbose ist der letzte im Handel befindliche Vertreter, für den ein längerfristiger Nutzen nicht belegt ist. Blähungen infolge der bakteriellen Gärung der Kohlenhydrate im Dickdarm erfordern eine einschleichende Dosierung.
Insulin
Von allen Antidiabetika wirkt Insulin am stärksten blutzuckersenkend. Es fördert die Bildung von Fettsäuren aus Glukose, die Resorption von Glukose und Aminosäuren in die Zellen, die Umsetzung von Zucker zur Energiegewinnung und die Synthese von Speicherzucker (Glykogen) in der Leber und den Muskeln. Seine Effekte werden über in Leber-, Fett- und Muskelzellen lokalisierte Insulinrezeptoren vermittelt. Für die Therapie sind verschiedene Arten von Insulin verfügbar, mit unterschiedlich schnellem Wirkeintritt und andauernder Wirkung (s. Tab. Einteilung von Insulinen).
Eine Insulintherapie erfordert eine umfangreiche Schulung, damit die Patienten mit den für die Behandlung notwendigen Gerätschaften und Notfallmaßnahmen vertraut sind.
Einteilung von Insulinen* |
||
|
Insulin |
Besonderheit |
Präparatebeispiele |
|
Normalinsulin (Humaninsulin) |
-gentechnisch hergestelltes Humanin- sulin |
Actrapid, Huminsulin |
|
Intermediärinsulin (NPH-, Verzögerungsinsuline) |
-gebunden an das basische Eiweiß Protamin, dadurch langanhaltende Wirkung -liegt als Suspension vor und muss vor der Injektion durchmischt werden |
Insuman Basal, Insulatard |
|
Insulinanaloga, kurzwirksam |
-chemische Modifikation oder veränderte Aminosäureabfolge -wirken schnell, über kurzen Zeitraum |
Novo Rapid, Humalog, Apidra |
|
Insulinanaloga, langwirksam |
-chemische Modifikation oder veränderte Aminosäureabfolge -wirken über einen langen Zeitraum |
Toujeo, Tresiba |
|
Mischinsuline |
-vorgefertigte Mischungen aus einem kurz- und langwirksamen Insulin |
Insuman-Comb, NovoMix 30 |
*beispielhafte Nennungen ohne Anspruch auf Vollständigkeit (Stand der Informationen: 12.10.2023)
Am HV-Tisch
Viele Menschen mit T2D suchen praktische Unterstützung in der Apotheke. Man sollte also stets passende Ratschläge zur richtigen Blutzuckermessung, Unterzucker und Ernährung parat haben.
Richtig Blutzucker messen
Wie oft Menschen mit T2D ihren Blutzucker kontrollieren sollen, hängt von verschiedenen Faktoren ab: etwa ob sie lediglich orale Antidiabetika einnehmen oder zusätzlich Insulin spritzen. Generell wird die Häufigkeit mit dem behandelnden Arzt vereinbart. Bei stabiler Stoffwechsellage sind weniger Messungen ausreichend, während bei Infekten oder im Urlaub lieber einmal mehr als zu wenig gemessen werden sollte. Die beste Stelle für die Blutgewinnung ist eine saubere, trockene Fingerbeere. In der kalten Jahreszeit oder bei Durchblutungsstörungen ist es hilfreich, sich vor dem Stechen die Hände mit warmem Wasser zu waschen und den jeweiligen Finger leicht zu massieren. Gelegentlich wird auch empfohlen, die Arme auszuschütteln oder die Hände eine Zeit lang seitlich herunterhängen zu lassen. Auf jeden Fall dürfen die Patienten ihren Finger nicht quetschen, da das austretende Gewebewasser die Messwerte verfälschen kann.

© Foto: Grafik: DAS PTA MAGAZIN / Illustration: Mone Beeck
Eine Hypoglykämie ist die häufigste Nebenwirkung einer Insulintherapie, bei der schnell gehandelt werden muss.
Unterzucker behandeln
Die häufigste, akute Komplikation einer Diabetestherapie ist der Unterzucker (Hypoglykämie). Je strenger der Blutzucker eingestellt ist, desto geringer ist das Risiko für Spätfolgen, aber desto wahrscheinlicher sind Unterzuckerungen. Ursache Nummer 1 ist eine laufende Insulintherapie (Insulin > Sulfonylharnstoffe > orale Antidiabetika). Definitionsgemäß fällt bei einer Hypoglykämie der Blutzucker auf unter 50 mg/dl. Symptome wie Kaltschweiß, Heißhunger und Verwirrtheit (Whipple-Trias) können sich aber schon deutlich früher bemerkbar machen. Unruhe, Zittern und Tachykardie sind Zeichen der adrenergen Gegenregulation. Müdigkeit, Sprach- und Sehstörungen gelten als Ergebnis der mangelhaften Glukoseversorgung des Gehirns.
Behandelt werden Unterzuckerungen vorzugsweise mit rasch wirksamen Kohlenhydraten. Das sind zum Beispiel Traubenzucker, zuckerhaltige Softdrinks und Fruchtsäfte. Schokolade, Müsliriegel sowie andere fett- und eiweißhaltige Süßigkeiten sind weniger geeignet, weil es länger dauert, bis die enthaltenen Kohlenhydrate in die Blutbahn aufgenommen werden. Für den Notfall gibt es glukagonhaltige Spritzen und Nasensprays, die von geschulten Angehörigen verabreicht werden.
Ernährungsfragen
Als metabolische Erkrankung beeinflusst T2D nicht nur den Kohlenhydratstoffwechsel, sondern ebenso den Eiweiß- und Fettstoffwechsel. Aus diesem Grund sollten die Patienten stets dazu ermuntert werden, ein Auge auf ihre Ernährung zu werfen. Empfohlen wird ein mediterranes beziehungsweise nordisches Ernährungsschema mit vielen ungesättigten Fettsäuren aus unbehandelten Nüssen, pflanzlichen Ölen und Fisch. Eine Ernährung nach diesen Schemata senkt das kardiovaskuläre Risiko und hilft, den Blutzucker im Zaum zu halten. Sinnvoll ist auch der Verzicht auf gesättigte Fette etwa aus Wurst, verarbeiteten Lebensmitteln und fettem Fleisch. Reichlich Gemüse sollte ebenfalls auf keinem Diabetikertisch fehlen. 500 bis 700 Gramm Obst und Gemüse am Tag („5-a-day“ bzw. fünf geballte Fäuste) tragen zu einer ausreichenden Versorgung mit allen nötigen Vitaminen, Mineralstoffen und Spurenelementen bei. Besteht der Wunsch nach einer Nahrungsergänzung, können Omega-3-Fettsäuren helfen, erhöhte Triglyzeridwerte zu senken.
Pausieren der Medikation
An Tagen, an denen sich die Patienten nicht wohlfühlen ( „sick days“) empfiehlt es sich, Metformin und SGLT-2-Hemmer zu pausieren, um das Auftreten einer Laktatazidose bzw. einer euglykämischen Ketoazidose (= ketonkörperbedingte Azidose, wobei der Blutzucker innerhalb der normalen Grenzen liegt) zu vermeiden. „Sick days“ sind unter anderem fieberhafte Infekte, Übelkeit/Erbrechen oder Durchfälle. Auch vor Operationen sollten diese Medikamente und Sulfonylharnstoffe vorsorglich pausiert werden. Das individuelle Vorgehen erfolgt am besten in Absprache mit dem Arzt.
Interessenskonflikt: Der Autor erklärt, dass keinerlei Interessenskonflikte bezüglich des Themas vorliegen.
Zertifizierte Fortbildung: Typ-2-Diabetes | DAS PTA MAGAZIN - das-pta-magazin.de
Read More

No comments:
Post a Comment